Thông cáo báo chí: Giải thưởng Nobel về Sinh lý học và Y học 2019

William G. Kaelin Jr., Peter J. Ratcliffe và Gregg L. Semenza đã khám phá ra cách thức các tế bào có thể cảm nhận và thích nghi với sự thay đổi lượng oxy có sẵn. Các nhà khoa học đã xác định được cơ chế phân tử điều hòa hoạt động của gen để đáp ứng với các mức độ oxy khác nhau.
Các khám phá quan trọng của các nhà khoa học đạt giải Nobel năm nay đã cho thấy cơ chế của một trong những quá trình thích nghi thiết yếu nhất của sự sống. Các nhà khoa học đã thiết lập cơ sở cho sự hiểu biết của chúng ta về cách thức mức độ oxy ảnh hưởng đến quá trình chuyển hóa tế bào và chức năng sinh lý. Những khám phá này cũng mở đường cho những liệu pháp mới đầy hứa hẹn để chống lại bệnh thiếu máu, ung thư và nhiều bệnh khác.
Oxy ở giai đoạn trung tâm
Oxy, với công thức O2, chiếm khoảng 1/5 bầu khí quyển Trái đất. Oxy rất cần thiết cho đời sống động vật: nó được sử dụng bởi ty thể có trong hầu hết các tế bào động vật để chuyển đổi thức ăn thành năng lượng hữu ích. Otto Warburg, nhà khoa học nhận giải thưởng Nobel về sinh lý học hoặc y học năm 1931 chỉ ra rằng quá trình chuyển đổi này là một quá trình enzyme.
Trong quá trình tiến hóa, các cơ chế được phát triển để đảm bảo cung cấp đủ oxy cho các mô và tế bào. Cơ thể động mạch cảnh (carotid body), liền kề với các mạch máu lớn ở hai bên cổ có chứa các tế bào chuyên biệt cảm nhận mức oxy trong máu. Giải thưởng Nobel về sinh lý học hoặc y học năm 1938 đã được trao cho Corneille Heymans bởi khám phá của ông của cho thấy việc cảm nhận oxy trong máu qua cơ thể động mạch cảnh có thể kiểm soát nhịp hô hấp của chúng ta bằng cách giao tiếp trực tiếp với não.
Tác nhân cảm ứng thiếu oxy (HIF: hypoxia-inducible factor)
Ngoài việc thích ứng nhanh được kiểm soát bởi cơ thể động mạch cảnh với các mức oxy thấp (thiếu oxy), còn có những điều chỉnh sinh lý cơ bản khác. Một phản ứng sinh lý quan trọng đối với tình trạng thiếu oxy là sự gia tăng nồng độ hormone erythropoietin (EPO), dẫn đến tăng sản xuất hồng cầu. Tầm quan trọng của việc kiểm soát nội tiết của hồng cầu đã được biết đến vào đầu thế kỷ 20, nhưng quá trình này được tự kiểm soát bởi oxy bằng cách nào vẫn còn là một bí ẩn.
Gregg Semenza đã nghiên cứu gen EPO và cách nó được điều hòa bởi nồng độ oxy khác nhau. Bằng cách sử dụng chuột biến đổi gen, các đoạn DNA cụ thể nằm bên cạnh gen EPO đã được phát hiện làm trung gian cho phản ứng với tình trạng thiếu oxy. Peter Ratcliffe cũng đã nghiên cứu sự điều hòa phụ thuộc oxy của gen EPO và cả hai nhóm nghiên cứu đều phát hiện ra rằng cơ chế cảm nhận oxy có mặt trong hầu như tất cả các mô, không chỉ trong các tế bào thận, nơi EPO thường được sản xuất. Đây là những phát hiện quan trọng cho thấy cơ chế này là chức năng chung trong nhiều loại tế bào khác nhau.
Semenza muốn xác định các thành phần tế bào làm trung gian cho phản ứng này. Trong các tế bào gan nuôi cấy, ông đã phát hiện ra một phức hợp protein liên kết với đoạn DNA được xác định trong một cách thức phụ thuộc oxy. Ông gọi phức hợp này là tác nhân cảm ứng thiếu oxy (HIF: hypoxia-inducible factor). Các nổ lực để tinh sạch phức hợp HIF đã được bắt đầu, và vào năm 1995 Semenza đã có thể công bố một số phát hiện quan trọng của mình, bao gồm cả việc xác định các gen mã hóa HIF. HIF được tìm thấy bao gồm hai protein liên kết DNA khác nhau. Trước đây chúng được gọi là các yếu tố phiên mã, nhưng hiện nay được đặt tên là HIF-1α và ARNT.
VHL: một đối tác bất ngờ
Khi nồng độ oxy cao, các tế bào chứa rất ít HIF-1α. Tuy nhiên, khi nồng độ oxy thấp, lượng HIF-1α tăng lên để nó có thể liên kết và điều hòa gen EPO cũng như các gen khác có các đoạn DNA gắn HIF (Hình 1). Một số nhóm nghiên cứu cho thấy HIF-1α (thường bị phân hủy nhanh chóng trong điều kiện oxy bình thường) được bảo vệ khỏi sự phân hủy trong tình trạng thiếu oxy. Ở mức oxy bình thường, một bộ máy di động được gọi là proteasome, được công nhận bởi giải thưởng Nobel về hóa học năm 2004 cho Aaron Ciechanover, Avram Hershko và Irwin Rose, sẽ phân hủy HIF-1α. Trong điều kiện như vậy, một peptide nhỏ (ubiquitin) được thêm vào protein HIF-1α. Ubiquitin có chức năng như một nhãn của các protein được định sẵn cho sự phân hủy của proteasome. Bằng cách nào ubiquitin có thể liên kết với HIF-1α theo cách phụ thuộc oxy vẫn còn là một câu hỏi chính.
Câu trả lời đến từ một hướng bất ngờ. Trong cùng thời gian Semenza và Ratcliffe tìm hiểu về quá trình điều hòa của gen EPO, nhà nghiên cứu ung thư William Kaelin, Jr. cũng đang nghiên cứu một hội chứng di truyền, bệnh von Hippel-Lindau (bệnh VHL). Bệnh di truyền này dẫn đến tăng đáng kể nguy cơ mắc một số bệnh ung thư trong các gia đình có đột biến VHL di truyền. Kaelin đã chỉ ra rằng gen VHL mã hóa một loại protein ngăn ngừa sự tấn công của bệnh ung thư. Kaelin cũng chỉ ra rằng các tế bào ung thư thiếu một gen chức năng VHL sẽ biểu hiện các gen điều hòa thiếu oxy cao một cách bất thường; nhưng khi gen VHL được đưa vào tế bào ung thư, mức độ biểu hiện bình thường đã được phục hồi. Đây là một manh mối quan trọng cho thấy VHL bằng cách nào đó có liên quan đến việc kiểm soát các phản ứng đối với tình trạng thiếu oxy. Các manh mối bổ sung đến từ một số nhóm nghiên cứu cho thấy VHL là một phần của phức hợp gắn nhãn protein với ubiquitin, đánh dấu cho sự phân hủy proteasome. Ratcliffe và nhóm nghiên cứu của ông sau đó đã thực hiện một khám phá quan trọng: chứng minh rằng VHL có thể tương tác vật lý với HIF-1α và cần thiết cho sự phân hủy của nó ở mức oxy bình thường. Đây chính là liên kết của VHL với HIF-1α.
Oxy giúp cân bằng
Các nghiên cứu hướng về cùng một chủ đề, tuy nhiên cách thức các mức O2 điều hòa sự tương tác giữa VHL và HIF-1α vẫn chưa được biết. Việc tìm kiếm tập trung vào một phần cụ thể của protein HIF-1α rất quan trọng đối với sự phân hủy phụ thuộc VHL, và cả Kaelin và Ratcliffe đều nghi ngờ rằng chìa khóa của cảm biến O2 nằm ở đâu đó trong domain protein này. Năm 2001, trong hai bài báo được xuất bản đồng thời, hai ông đã chỉ ra rằng trong điều kiện oxy bình thường, các nhóm hydroxyl được thêm vào ở hai vị trí cụ thể của HIF-1α (Hình 1). Sự biến đổi protein này được gọi là prolyl hydroxylation, cho phép VHL nhận biết và liên kết với HIF-1α, từ đó giải thích được rằng mức độ oxy bình thường có thể kiểm soát sự phân hủy HIF-1α nhanh chóng với sự trợ giúp của các enzyme nhạy cảm với oxy (được gọi là prolyl hydroxylase ). Các nghiên cứu tiếp theo của Ratcliffe và các nhà khoa học khác đã xác định các hydroxylase prolyl chịu trách nhiệm. Nó cũng cho thấy chức năng kích hoạt gen của HIF-1α được điều hòa bởi quá trình hydroxyl hóa phụ thuộc oxy. Các nhà khoa học đoạt giải Nobel năm nay đã làm sáng tỏ cơ chế cảm biến oxy và cách thức hoạt động của nó.
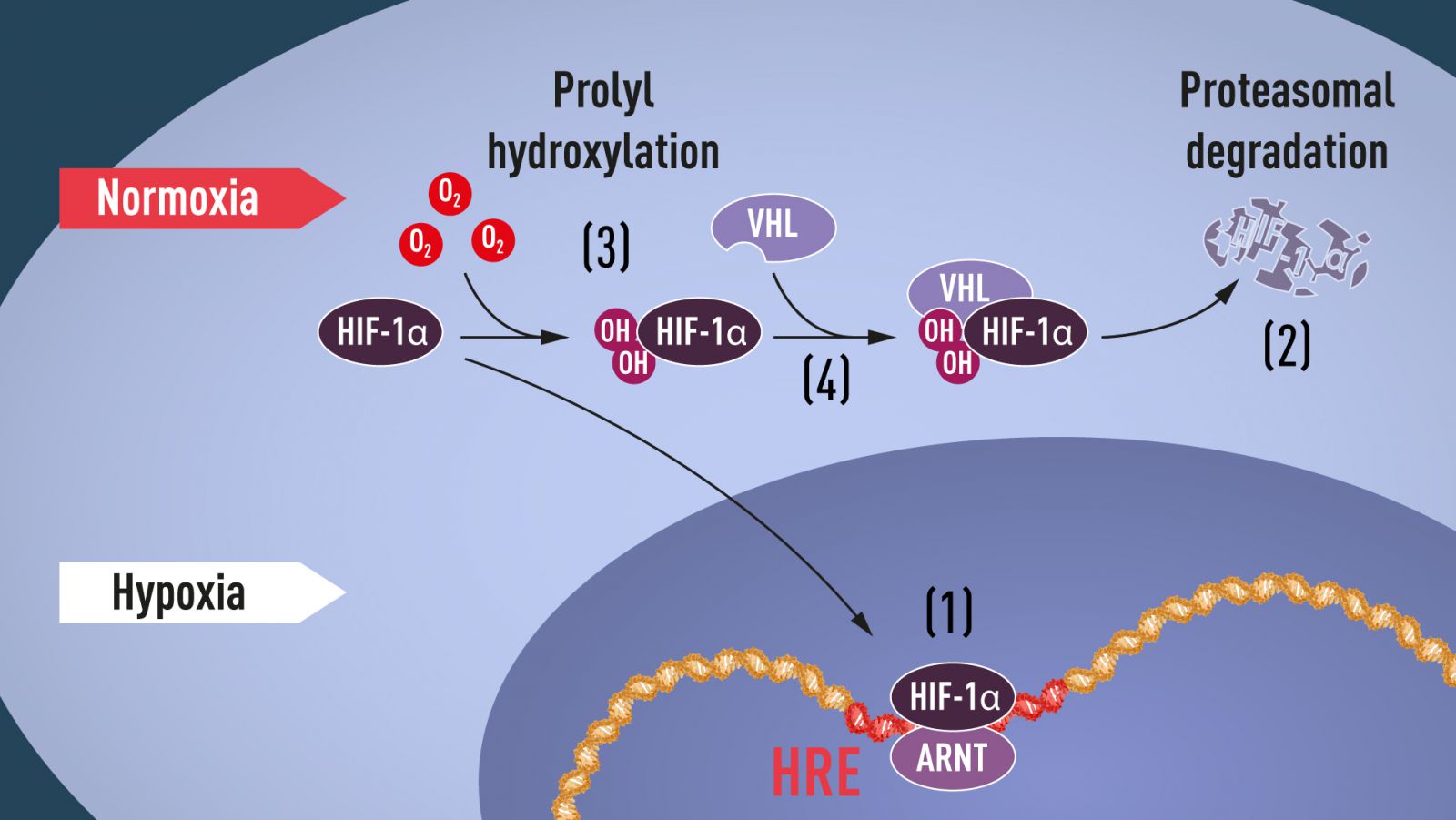
Hình 1. Khi nồng độ oxy thấp (thiếu oxy), HIF-1α được bảo vệ khỏi sự phân hủy và tích lũy trong nhân, nơi nó liên kết với ARNT và liên kết với các chuỗi DNA cụ thể (HRE) trong các gen do thiếu oxy điều hòa (1). Ở mức oxy bình thường, HIF-1α bị phân hủy nhanh chóng bởi proteasome (2). Oxy điều hòa quá trình phân hủy bằng cách thêm các nhóm hydroxyl (OH) vào HIF-1α (3). Protein VHL sau đó có thể nhận ra các nhóm hydroxyl và tạo thành phức hợp với HIF-1α, dẫn đến sự phân hủy phụ thuộc oxy (4).
Oxy định hình sinh lý và bệnh lý
Nhờ vào công trình đột phá của các nhà khoa học đoạt giải Nobel, chúng ta biết nhiều hơn về cách các mức oxy khác nhau điều chỉnh các quá trình sinh lý cơ bản. Cảm biến oxy cho phép các tế bào thích ứng quá trình trao đổi chất của chúng với các mức oxy thấp: ví dụ, trong cơ bắp của chúng ta trong quá trình tập luyện cường độ cao. Các ví dụ khác về các quá trình thích nghi được điều khiển bằng cảm biến oxy bao gồm việc tạo ra các mạch máu mới và sản xuất các tế bào hồng cầu. Hệ thống miễn dịch của chúng ta và nhiều chức năng sinh lý khác cũng được tinh chỉnh bởi bộ phận cảm biến oxy. Cảm biến oxy thậm chí đã được chứng minh là rất cần thiết trong quá trình phát triển của thai nhi để kiểm soát sự hình thành mạch máu bình thường và sự phát triển của nhau thai.
Cảm biến oxy là trung tâm của nhiều loại bệnh khác nhau (Hình 2). Ví dụ, bệnh nhân suy thận mãn tính thường bị thiếu máu nặng do giảm biểu hiện EPO. EPO được sản xuất bởi các tế bào trong thận và rất cần thiết để kiểm soát sự hình thành các tế bào hồng cầu, như đã giải thích ở trên. Hơn nữa, bộ máy điều hòa oxy cũng có vai trò quan trọng trong bệnh ung thư. Trong các khối u, bộ máy điều hòa oxy được sử dụng để kích thích sự hình thành mạch máu và định hình lại quá trình trao đổi chất để tăng sinh hiệu quả các tế bào ung thư. Các nỗ lực không ngừng trong các phòng thí nghiệm hàn lâm và các công ty dược phẩm hiện đang tập trung vào việc phát triển các loại thuốc có thể can thiệp vào các tình trạng bệnh khác nhau bằng cách kích hoạt hoặc chặn bộ máy cảm nhận oxy.
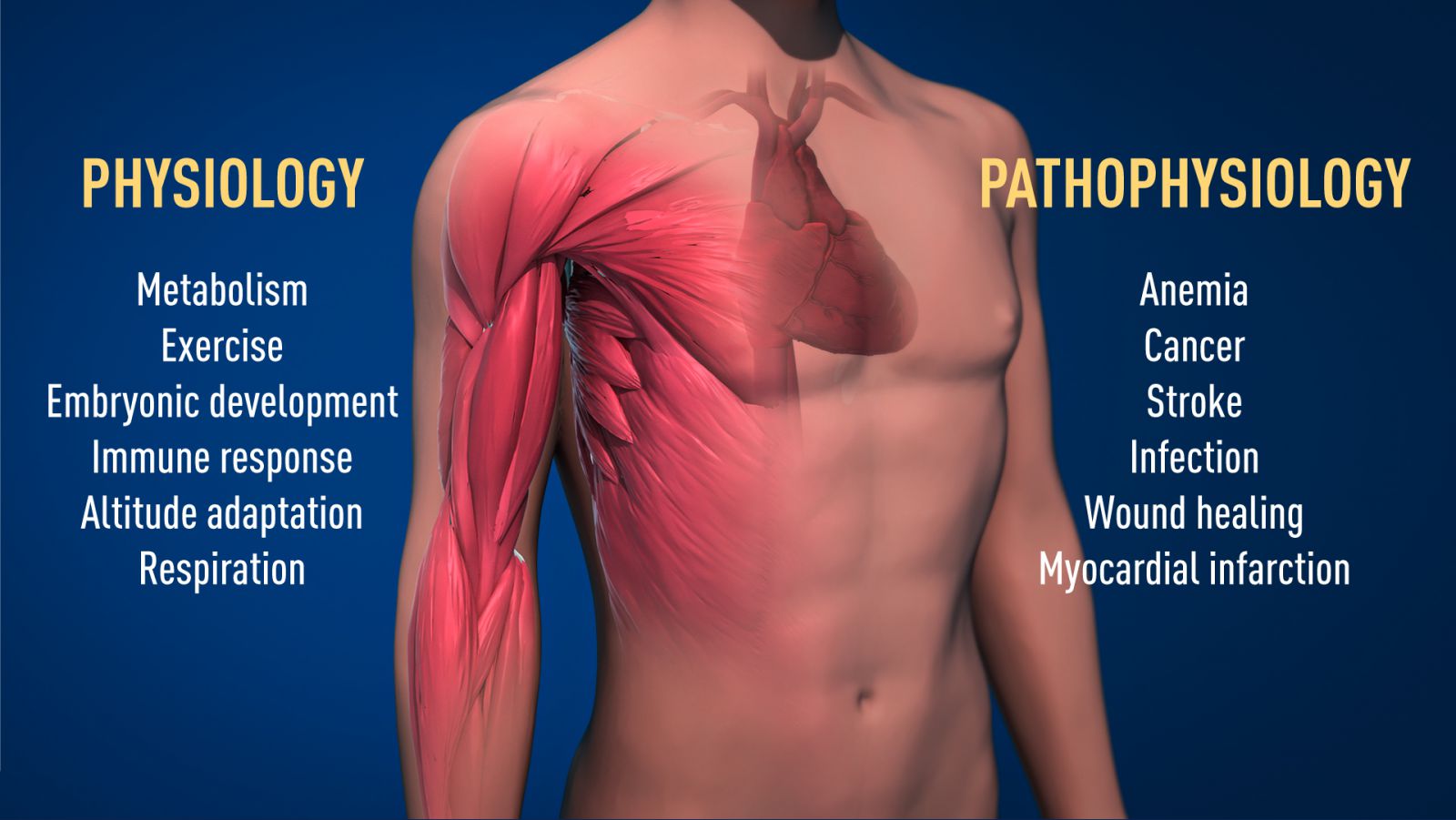
Hình 2. Cơ chế cảm nhận oxy có tầm quan trọng cơ bản trong sinh lý học, ví dụ như đối với sự trao đổi chất, phản ứng miễn dịch và khả năng thích ứng với sự luyện tập. Nhiều quá trình bệnh lý cũng bị ảnh hưởng. Những nỗ lực chuyên sâu đang tiếp tục phát triển các loại thuốc mới có thể ức chế hoặc kích hoạt bộ máy điều hòa oxy để điều trị bệnh thiếu máu, ung thư và các bệnh khác.
CÁC CÔNG BỐ CHÍNH
Semenza, G.L, Nejfelt, M.K., Chi, S.M. & Antonarakis, S.E. (1991). Hypoxia-inducible nuclear factors bind to an enhancer element located 3’ to the human erythropoietin gene. Proc Natl Acad Sci USA, 88, 5680-5684
Wang, G.L., Jiang, B.-H., Rue, E.A. & Semenza, G.L. (1995). Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension. Proc Natl Acad Sci USA, 92, 5510-5514
Maxwell, P.H., Wiesener, M.S., Chang, G.-W., Clifford, S.C., Vaux, E.C., Cockman, M.E., Wykoff, C.C., Pugh, C.W., Maher, E.R. & Ratcliffe, P.J. (1999). The tumour suppressor protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis. Nature, 399, 271-275
Mircea, I., Kondo, K., Yang, H., Kim, W., Valiando, J., Ohh, M., Salic, A., Asara, J.M., Lane, W.S. & Kaelin Jr., W.G. (2001) HIFa targeted for VHL-mediated destruction by proline hydroxylation: Implications for O2 sensing. Science, 292, 464-468
Jakkola, P., Mole, D.R., Tian, Y.-M., Wilson, M.I., Gielbert, J., Gaskell, S.J., von Kriegsheim, A., Heberstreit, H.F., Mukherji, M., Schofield, C.J., Maxwell, P.H., Pugh, C.W. & Ratcliffe, P.J. (2001). Targeting of HIF-α to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation. Science, 292, 468-472
VÀI NÉT VỀ CÁC NHÀ KHOA HỌC ĐẠT GIẢI NOBEL SINH LÝ HỌC VÀ Y KHOA NĂM 2019
William G. Kaelin, Jr. sinh năm 1957 tại New York. Ông đã lấy bằng Bác sĩ Y khoa (MD) tại Đại học Duke, Durham. Ông đã được đào tạo chuyên gia về nội khoa và ung thư tại Đại học Johns Hopkins, Baltimore và tại Viện Ung thư Dana-Farber, Boston. Ông đã thành lập phòng thí nghiệm nghiên cứu của riêng mình tại Viện Ung thư Dana-Farber và trở thành giáo sư chính thức tại Trường Y Khoa Harvard vào năm 2002. Ông cũng là một điều tra viên của Viện Y khoa Howard Hughes từ năm 1998.
Peter J. Ratcliffe sinh năm 1954 tại Lancashire, Vương quốc Anh. Ông học y khoa tại trường Gonville và Caius, Đại học Cambridge và đã được đào tạo chuyên gia về thận học tại Oxford. Ông đã thành lập một nhóm nghiên cứu độc lập tại Đại học Oxford và trở thành giáo sư chính thức vào năm 1996. Ông là Giám đốc Nghiên cứu Lâm sàng tại Viện nghiên cứu Francis Crick, London, Giám đốc Viện Khám phá Mục tiêu tại Oxford và là thành viên của Viện Nghiên cứu Ung thư Ludwig.
Gregg L. Semenza sinh năm 1956 tại New York. Ông lấy bằng Cử nhân Sinh học tại Đại học Harvard, Boston. Ông đã nhận bằng Bác sĩ/Tiến sĩ Y khoa tại trường Y khoa, Đại học Pennsylvania, Philadelphia năm 1984 và được đào tạo như một chuyên gia về nhi khoa tại Đại học Duke, Durham. Ông nghiên cứu sau tiến sĩ tại Đại học Johns Hopkins, Baltimore, nơi ông đã thành lập một nhóm nghiên cứu độc lập của mình. Ông trở thành giáo sư chính thức tại Đại học Johns Hopkins năm 1999 và từ năm 2003 ông là Giám đốc Chương trình Nghiên cứu Mạch máu tại Viện Kỹ thuật Tế bào Johns Hopkins.
Nguồn: www.nobelprize.org










